NOMENCLATURA ORGÁNICA
REGLAS BÁSICAS
Nomenclatura significa nombrar o formular compuestos químicos. Existen reglas que son útiles para cualquiera de las familias de los compuestos orgánicos y las cuales a continuación procederemos a mencionar.
1.- La cadena principal: es aquella que reúne las siguientes características:
a) Es la que posee mayor número de carbonos.
b) Es la más lineal o recta posible.
c) Presenta la mayor o total cantidad de grupos funcionales(lo que caracteriza a una familia) y sobre todo el grupo funcional de mayor importancia.
Para nombrarla se emplean los siguientes prefijos de acuerdo a la cantidad de carbonos que posea:
met = 1 C; et = 2 C; prop = 3 C; but = 4 C; pent = 5 C
hex = 6 C; hept = 7 C; oct = 8 C; non = 9 C; dec = 10 C
undec = 11 C; dudec = 12 C; tridec = 13 C, etc.
Finalizando el nombre con el sufijo característico de la familia correspondiente al compuesto.
2.- Los radicales (sustituyentes) o cadenas secundarias: son todas las cadenas carbonadas que no quedan incluidas dentro de la cadena principal, se nombran indicando primero el prefijo de cantidad y luego los sufijos il(cuando todos sus enlaces químicos son sencillos), enil (si presentan un doble enlace) e inil(si presenta un triple enlace).
Ejemplo: Metil (-CH3); etil (-CH2CH3); etenil (-CH=CH2);
etinil(-C≡CH).
3.- Cuando un radical o grupo funcional se repite varias veces en un compuesto para señalarlos se emplean los siguientes prefijos:
di = 2 veces. tri = 3 veces. tetra = 4 veces
penta = 5 veces. hexa = 6 veces. hepta = 7 veces. etc.
4.- Para señalar los radicales en el nombre de los compuestos estos se deben ordenar en orden alfabético, sin tomar en consideración los prefijos de cantidad.
5.- Para nombrar el compuesto se debe numerar la cadena carbonada comenzando por el extremo o carbono más cercano a un radical más voluminoso o grupo funcional de mayor importancia, esto en el caso de los compuestos de cadena abierta, ya que de ser de cadena cerrada el carbono Nº 1 será el que posea el radical más voluminoso o grupo funcional más importante.
6.- Para señalar los radicales o grupos funcionales en el nombre del compuesto se indica el(los) número(s) del carbono(s) de la cadena principal donde se ubica(n). Si aparece varias veces deben aparecer tantos números como veces que se repite y los mismos deben estar separados por una coma.
7.- Entre número y palabra debe existir un guión (-).
8.- Los grupos funcionales y radicales se ordenan en el nombre del compuesto en orden alfabético, pero el compuesto llevará el nombre de la familia de mayor importancia que exista en la estructura del compuesto.Cualquier otra regla se establecerá con la familia correspondiente.
Ejemplo de algunos radicales de mayor uso
a) Radicales que emplean el prefijo iso: son aquellos que poseen un metil sobre el penúltimo carbono de su cadena lineal.
Importante
Observa que para nombrarlos se cuenta la totalidad de carbonos que existen en la estructura y el carbono número uno de la cadena lineal es el unido a la cadena principal.
b) Radicales que emplean el prefijo sec, son los que presentan un metil ramificado sobre el primer carbono de su cadena lineal.
HIDROCARBUROS
Son los compuestos orgánicos que presentan en su estructura solamente los elementos carbono e hidrógeno. Un ejemplo claro de este tipo de compuestos orgánicos es el petróleo.
Los hidrocarburos se clasifican de la siguiente manera:
a) Alifáticos: Son los que presentan cadena carbonada abierta, es decir que la cadena comienza en un carbono y finaliza en otro carbono distinto. Estos a su vez pueden ser:
a.1.-Saturados:Son los que todos sus carbonos poseen hibridización sp3 lo que indica la cantidad máxima de hidrógenos permitidos (cuatro), produciendo que todos los enlaces químicos sean sencillos.
a.2.-Insaturados: Son los que en su estructura poseen enlaces químicos dobles, carbonos con hibridización sp2 o triples donde los carbonos presentan hibridización sp.
b) Alicíclicos: Son los que presentan la cadena carbonada principal cerrada, es decir la cadena comienza en un carbono y finaliza en el mismo carbono. Estos también pueden ser saturados e Insaturados.
c)Aromáticos: Son compuestos de cadena cerrada de seis carbonos que presentan tres enlaces dobles y tres sencillos alternados.
NOMENCLATURA DE HIDROCARBUROS ALIFATICOS
Los hidrocarburos alifáticos se clasifican en familias que son:
1.- Alcanos: Son hidrocarburos saturados. Para nombrarlos se emplea el sufijo ano después del prefijo correspondiente a la cantidad de carbonos que posee la cadena principal. La fórmula general es:
CnH2n + 2
Ejemplo:
a) metano (CH4)
met = un solo carbono en la cadena principal
ano = sufijo correspondiente a la familia.
b) propano (CH3CH2CH3)
prop = tres carbonos en la cadena principal
ano = sufijo correspondiente a la familia
2.- Alquinos: Son hidrocarburos Insaturados, ya que poseen un triple enlace en su estructura. Para nombrarlos se utiliza el sufijo ino después del prefijo correspondiente a la cantidad de carbonos de la cadena principal, se debe indicar el número del carbono donde se ubica el triple enlace (cuando se ubica en el Nº 1 no es necesario mencionarlo).
Su fórmula general es:
CnH2n - 2
Ejemplo:
a) Etino (CH≡CH)
Et = dos carbonos en la cadena principal
ino = sufijo correspondiente a la familia
1 2 3 4
b) 2-butino (CH3C≡CCH3)
2-but = sobre el carbono Nº 2 se localiza el triple enlace y posee cuatro carbonos la cadena principal.
ino = sufijo correspondiente a la familia
3.- Alquenos: También son insaturados, debido a que presentan un doble enlace en su estructura. Se emplea el sufijo eno después del prefijo que indica la cantidad de carbonos de la cadena principal y también se debe señalar el número del carbono en el que se encuentra la insaturación (si esta en el primer carbono no es necesaria).
Su fórmula general es:
CnH2n
Ejemplo:
a) Propeno (CH2=CHCH3)
Prop = 3 carbonos en la cadena principal
eno = sufijocorrespondiente a la familia
1 2 3 4 5
b) 2-penteno (CH3CH=CHCH2CH3)
2-pent = sobre carbono Nº 2 de la cadena principal se localiza el doble enlace y la cadena consta de 5 carbonos.
eno = sufijo correspondiente a la familia
EJERCICIOS
1.- Nombra los siguientes hidrocarburos.
2.- Señala la estructura semidesarrollada de los siguientes hidrocarburos.
a) 3-etil-6-isopropil-2-metil-4-secbutil-2-octeno
b) 6,6,8,8-tetrametil-4-propil-4-secpentil-2-nonimo
c) 2-etil-4-propil-3-hexeno
d) 3,4-sietil-5-isopropil-2,6-dimetilocteno
e) 4,5-dimetil-3-secbutil-7-ino-2-octeno.
f) 4-isobutil-2,5-dimetilheptano
g) 3-etil-2,3,5-trimetilnonano
h) 3,6-dietilocteno
i) 2,4-dimetil-3-isopropilheptano
HIDROCARBUROS DE CADENA CERRADA
Son hidrocarburos de cadena cerrada por estar compuestos de carbono e hidrógeno solamente y por su cadena carbonada principal comenzar en un carbono y terminar en él mismo.
Las familias de los hidrocarburos de cadena cerrada son:
a) Cicloalcanos
b) Cicloalquenos
c) Cicloalquinos
d) Aromáticos
Las tres primeras familias son similares a los hidrocarburos de cadena abierta en cuanto a sus propiedades físicas y químicas, para nombrarlos se siguen las siguientes normas:
a) Se comienza a numerar la cadena por el carbono que permita que la insaturación o ramificación más voluminosa se ubique en el carbono más bajo en número, en el caso de las Cicloalcanos por aquel carbono que contenga una ramificación.
b) Para nombrarlos se antepone la palabra Ciclo al prefijo de cantidad y se hace terminar utilizando el sufijo de acuerdo a la familia (ano, eno, ino).
c) Las demás reglas son similares a los de cadena abierta.
d) La dirección de numeración será en el sentido de dar el menor número a las ramificaciones o sustituyentes.
Ejemplo:
EJERCICIOS
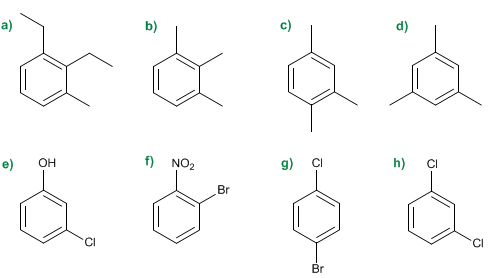
1.- Nombra los siguientes compuestos orgánicos.
2.- Indica la estructura semidesarrollada para los siguientes compuestos orgánicos.
a) 6 – etil – 4 – metil – 4 – propilciclohexeno
b) 2 – etil – 3 – isobutil – 4,4- dipropilciclopenteno
c) 2 - cilopentil – 1 – ciclohexilciclohexano
d) 3,4 – dipropilciclohexino
e) Secpentilciclooctano
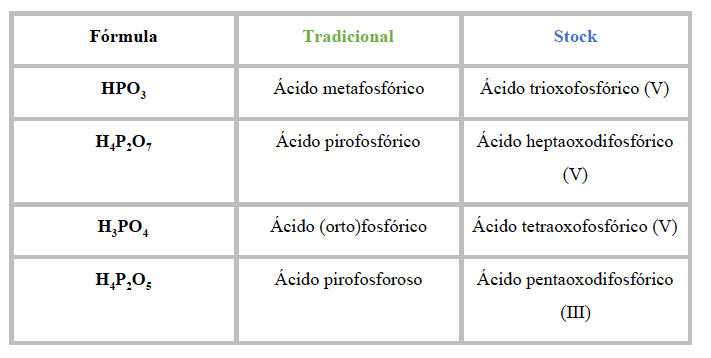
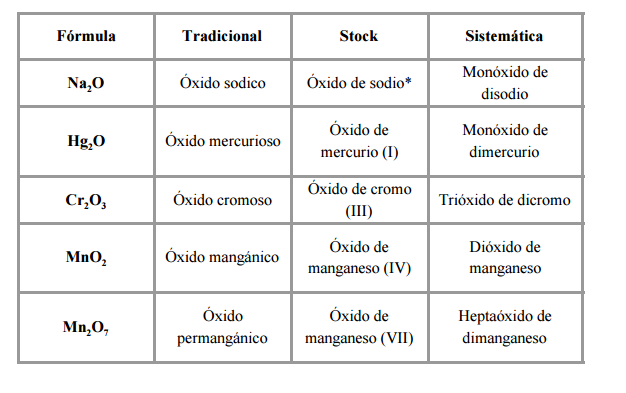
 Donde el hidrógeno (H) actúa con estado de oxidación +1 hace referencia a la parte electropositiva del compuesto, mientras que el oxígeno (O), que actúa con estado de oxidación -2, y el elemento no metálico ”X” (generalmente) constituyen la parte electronegativa del mismo.
Donde el hidrógeno (H) actúa con estado de oxidación +1 hace referencia a la parte electropositiva del compuesto, mientras que el oxígeno (O), que actúa con estado de oxidación -2, y el elemento no metálico ”X” (generalmente) constituyen la parte electronegativa del mismo.