ÓXIDOS BÁSICOS O METÁLICOS
Los óxidos básicos o metálicos están formados por un elemento metálico más oxígeno. Se trata de compuestos binarios cuya fórmula X2On (donde X es el elemento metálico y O es oxígeno). En estos compuestos el oxígeno presenta un estado de oxidación -2, definirían la parte electronegativa del compuesto y se denominaría “óxido”. La lectura de los compuestos se realiza nombrando el óxido seguido del elemento que le precede.
ÓXIDOS ÁCIDOS O NO METÁLICOS
Los óxidos ácidos o no metálicos están formados por un elemento no metálico más oxígeno. Se trata de compuestos binarios cuya fórmula X2On (donde X es el elemento no metálico y O es oxígeno). En estos compuestos el oxígeno presenta un estado de oxidación -2, definirían la parte electronegativa del compuesto y se denominaría “óxido”(antes se les denominaban "Anhidridos"). La lectura de los compuestos se realiza nombrando el óxido seguido del elemento que le precede.
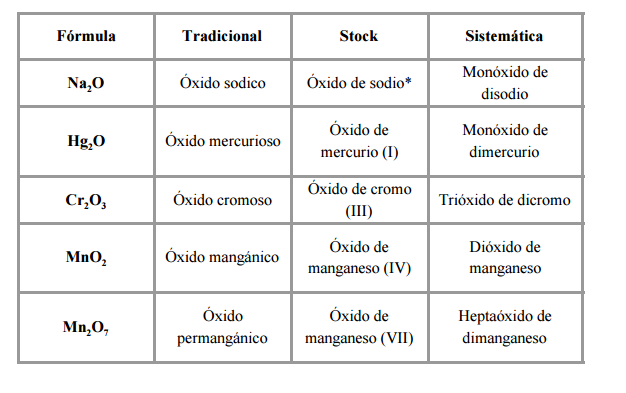
La nomenclatura tradicional: se nombra con la palabra óxido seguida del elemento metálico (teniendo en cuenta la valencia del elemento metálico).

* Cuando el elemento sólo tiene una valencia no es necesario indicar el estado de oxidación. Los prefijos en el elemento metálico se añaden cuando puede llevar a confusión el no incluirlos.
La nomenclatura de stock: indicando el estado de oxidación del elemento metálico en número romanos (entre paréntesis) y siempre determinado por la expresión «óxido de» + elemento metálico.
ejemplos:
Fe2O3 = Óxido de hierro (III)
FeO (viene de la simplificación de la formula molecular Fe2O2) = Óxido de hierro (II) es II porque esta usando su valencia n° 2
K2O = Óxido de potasio (I)
Nomenclatura sistemática (IUPAC): se indica mediante un prefijo el número de átomos de cada elemento.
Los prefijos utilizados que indican el número de átomos en esta nomenclatura son:
1 átomo: Mono
2 átomos: Di
3 átomos: Tri
4 átomos: Tetra
5 átomos: Penta
6 átomos: Hexa
7 átomos: Hepta
8 átomos: Octa
9 átomos: Nano
10 átomos: Deca
ejemplos:
Fe2O3 = Trioxido de diHierro
FeO = Monoxido de Hierro
otra forma de aplicar la nomenclatura IUPAC seria asi:
____1_____+Oxido de ____2_____+Nombre del elemento
1: prefijo que indica el n° de atomos de oxigeno
2: prefijo que indica el n° de atomos del elemento (y se colo solo si es "mayor o igual a 2)
* Cuando el elemento sólo tiene una valencia no es necesario indicar el estado de oxidación. Los prefijos en el elemento metálico se añaden cuando puede llevar a confusión el no incluirlos.
Los óxidos básicos o metálicos están formados por un elemento metálico más oxígeno. Se trata de compuestos binarios cuya fórmula X2On (donde X es el elemento metálico y O es oxígeno). En estos compuestos el oxígeno presenta un estado de oxidación -2, definirían la parte electronegativa del compuesto y se denominaría “óxido”. La lectura de los compuestos se realiza nombrando el óxido seguido del elemento que le precede.
ÓXIDOS ÁCIDOS O NO METÁLICOS
Los óxidos ácidos o no metálicos están formados por un elemento no metálico más oxígeno. Se trata de compuestos binarios cuya fórmula X2On (donde X es el elemento no metálico y O es oxígeno). En estos compuestos el oxígeno presenta un estado de oxidación -2, definirían la parte electronegativa del compuesto y se denominaría “óxido”(antes se les denominaban "Anhidridos"). La lectura de los compuestos se realiza nombrando el óxido seguido del elemento que le precede.
La nomenclatura tradicional: se nombra con la palabra óxido seguida del elemento metálico (teniendo en cuenta la valencia del elemento metálico).

* Cuando el elemento sólo tiene una valencia no es necesario indicar el estado de oxidación. Los prefijos en el elemento metálico se añaden cuando puede llevar a confusión el no incluirlos.
La nomenclatura de stock: indicando el estado de oxidación del elemento metálico en número romanos (entre paréntesis) y siempre determinado por la expresión «óxido de» + elemento metálico.
ejemplos:
Fe2O3 = Óxido de hierro (III)
FeO (viene de la simplificación de la formula molecular Fe2O2) = Óxido de hierro (II) es II porque esta usando su valencia n° 2
K2O = Óxido de potasio (I)
Nomenclatura sistemática (IUPAC): se indica mediante un prefijo el número de átomos de cada elemento.
Los prefijos utilizados que indican el número de átomos en esta nomenclatura son:
1 átomo: Mono
2 átomos: Di
3 átomos: Tri
4 átomos: Tetra
5 átomos: Penta
6 átomos: Hexa
7 átomos: Hepta
8 átomos: Octa
9 átomos: Nano
10 átomos: Deca
ejemplos:
Fe2O3 = Trioxido de diHierro
FeO = Monoxido de Hierro
otra forma de aplicar la nomenclatura IUPAC seria asi:
____1_____+Oxido de ____2_____+Nombre del elemento
1: prefijo que indica el n° de atomos de oxigeno
2: prefijo que indica el n° de atomos del elemento (y se colo solo si es "mayor o igual a 2)

* Cuando el elemento sólo tiene una valencia no es necesario indicar el estado de oxidación. Los prefijos en el elemento metálico se añaden cuando puede llevar a confusión el no incluirlos.
No hay comentarios:
Publicar un comentario